Георги Милошев
Позиция

Професор Георги Милошев е завършил „Молекулярна биология и генетика“ в Биологическия факултет на СУ „Кл. Охридски“. След завършването си, с изключение на няколко години във Великобритания, проф. Милошев работи в Института по молекулярна биология – БАН. В момента е ръководител на Лабораторията по Молекулярна генетика, епигенетика и дълголетие към ИМБ – „Акад. Р. Цанев“ – БАН. Интересите на проф. Милошев са в областта молекулярната генетика, епигенетиката, организацията и динамиката на хроматина, както и стареенето на клетките и влиянието на околната среда върху генома.
Законите на епигенетиката засягат всеки един от нас. Те привнасят допълнително към генетичните черти, които сме наследили от нашите родители, но също така ни допълват и с черти, които придобиваме в ежедневния си живот. Важно е да се подчертае, че епигенетиката създава у нас черти, които ние ще предадем на нашите деца.
Кой съм аз и как ще се развива моето тяло? Трябва ли да приличам на родителите си и дори задължително ли е да повтарям техните грешни и вредни навици? Защо напълнявам и мога ли да отслабна? С какво трябва да се храня? Колко да спортувам? С какво да храня децата си при съвременното промишлено производство на храни? И така нататък, и така нататък…
Тези и подобни въпроси са вълнували и продължават постоянно да вълнуват много от нас. Хората винаги са се интересували от това кое упражнява по-силен ефект върху тях и децата им – гените или пък възпитанието? На английски често се употребява изразът: Nature or nurture? (Природа или възпитание/отглеждане?). Например, ако страдаме от дълбоко вкоренени лични, емоционални проблеми, то те резултат ли са от някакъв генетичен проблем (мутация) или са ефект от средата и взаимоотношенията, в които сме отгледани? Или пък причината е и в двете? Отговорът на такива фундаментални въпроси може да бъде получен чрез изследванията в областта на една нова наука – Епигенетика.
Напоследък много се говори за нея. Нека се опитаме да внесем известна яснота в това какво е епигенетика, как се проявява тя и какви са последствията от действието на епигенетичните механизми.
Епигенетиката, заедно с направления като биохимия, генетика, физиология, молекулярна биология е част от общата биологична наука. Думата произхожда от приставката „епи-“, която на гръцки означава „над“, „допълнително“ или „по-съвършено“, и познатата дума „генетика“. Така буквалния превод е от рода на „надгенетика“. Hа български обаче това „над“ обикновено се възприема и като нещо по-висше, по-съвършено. Всъщност епигенетиката не е нещо по-висше или по-съвършено от генетиката. Генетиката е наука за наследствеността, т.е. как се предават черти от родители на деца, как се унаследяват морфологични и психологични черти. Отдавна е известно, че предаването на тези характеристики става чрез гените, които са кодирани в ДНК. Епигенетиката, от друга страна, се занимава с онази допълнителна наследственост, която се предава на поколението не директно чрез ДНК (чрез промяна в гените), а чрез други механизми. Затова определението за Епигенетика буквално звучи така:
„Епигенетиката е наука за онези наследствени характеристики, които се предават в поколението без промяна в гените и в генетичния код“. Това определение означава, че епигенетичното унаследяване е нестандартен механизъм. Чрез него родителски опит и придобити в живота черти могат да се предадат на следващите поколения чрез епигенетични механизми.
История
Интересен факт е, че епигенетиката не е нова наука. Някои учени представят първите опити за оформяне на епигенетика, като взимат думи от размислите на древногръцкия учен и философ Аристотел (384 – 322 пр.н.е.). Разбира се, в антична Гърция нито е имало сериозни научни данни, които да подкрепят твърдение за съществуване на епигенетика, нито самите думи на Аристотел се отнасят директно за епигенетично унаследяване. Всъщност Аристотел говори за „епигенезис“, нещо предначертано, нещо „съдържащо се изначално в живите форми“. Доколко това може да се свърже със съвременното понятие епигенетика е спорно и е въпрос философски анализ. А за истински „баща“ на епигенетиката като наука се приема Конрад Уодингтън (Conrad Waddington, 1905-1975). Той е английски учен, изключителен ерудит в областта на биологията. Занимавал се е с генетика, ембриология, биология на развитието, палеонтология и дори философия. Уодингтън за първи път рационално се опитва да реши един много интересен феномен: по какъв механизъм от една единствена оплодена яйцеклетка (зигота), която съдържа един диплоиден геном, се получават над 200 различни типове клетки, които изграждат тъканите и органите на човешкото тяло. Тези клетки съдържат абсолютно същия геном, значи еднаква генетична програма, и въпреки това са различни и извършват изключително разнообразни функции в организма. Та нали размерът, формата, метаболизмът, а и всички характеристики на клетките и организмите, зависят от това какви гени имат те. В труда си от 1940 г. Уодингтън предлага обяснение на този феномен чрез така наречения „епигенетичен пейзаж“ , станал впоследствие известен като „епигенетичен пейзаж на Уодингтън“
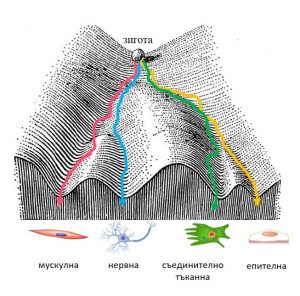
Епигенетичен пейзаж и диференциране на четирите основни типа клетки. Фигурата е адаптирана по оригиналната фигура на Конрад Уодингтън, публикувана през 1940 г
Според него, съдбата на една клетка, която се получава след деленето на оплодената яйцеклетка, прилича на заоблен камък на върха на долина. Когато камъкът се търкулне надолу по долината, той може да се спусне по едно от няколкото разклонения на долината, отварящи се пред него и така да пристигне на една от множеството различни точки на дъното. По аналогия всяка клетка, получена от деленето на зиготата, може да поеме по различен път на развитие и в крайна сметка да се превърне в един от двестате различни типа диференцирани клетки.
Основната идея на Уодингтън е, че съществуват някакви допълнителни механизми (освен основните генетични), които също могат да определят съдбата на живите организми. Тези механизми са наречени епигенетични. Тази и подобни идеи дълго време са били неглижирани и подминавани от водещите учени. Лично бях свидетел как основното внимание на науката до края на ХХ век бе съсредоточено главно върху ДНК и съответно – върху генетичните закони. Спомням си как преди около 40 години, когато за пръв път на институтски семинар чух израза „епигенетично унаследяване“ от именития наш учен академик Румен Цанев, тези думи бяха посрещнати с учудване, недоверие и леки усмивки! Обаче през 2005 г. Дейвид Алис публикува резултати от изследвания в неговата лаборатория, които недвусмислено показаха, че освен генетичния код в ДНК, информация може да се унаследява и чрез други механизми, като например химически модификации на протеините, които пакетират генома. Затова, ако трябва да изтъкнем точна рождена дата, то трябва да признаем, че съвременната Епигенетика възникна в началните години на ХХI век. Дейвид Алис (David Allis, 1951-2023), професор в един от най-престижните американски университети, Университета Рокфелър, бе сред първите ентусиасти в изследването и разпространението на знанията за епигентичните механизми. Той показа, че ензимът Gcn5p, който е хистон ацетилтрансфераза, се свързва с РНК полимераза и химически променя хистоните (протеинова информация), подпомагайки по този начин извършването на транскрипция, т.е. активирането на гените.

Академик Румен Цанев постави началото на епигенитичните изследвания в България още през 70-те години на миналия век
Що се отнася до България, то в нашата страна още от 70-те години на миналия век в Института по молекулярна биология (ИМБ) под ръководството на акад. Р. Цанев се изследваше един от най-мощните фактори на епигенетичните прояви – структурата и динамиката на хроматина. Изследванията, провеждани в ИМБ, през всичките тези години показаха много от интимните механизми на взаимодействие между ДНК и протеините, които в крайна сметка водят до правилната реакция на клетките и организмите към променящата се околна среда.
Но ако се върнем отново на епигенетичния пейзаж, предложен от Уодингтън, възниква въпросът „кой и как определя по коя долина да се спусне изначалната клетка, за да се превърне в крайно диференцирана клетка?“ Оказва се, че това по кой път да тръгне клетката може да се определи от редица фактори, намиращи се в самата клетка, но също така и от околната среда. За да разберем точно как става това трябва да представим накратко механизмите на епигенетиката.
Механизми на епигенетиката
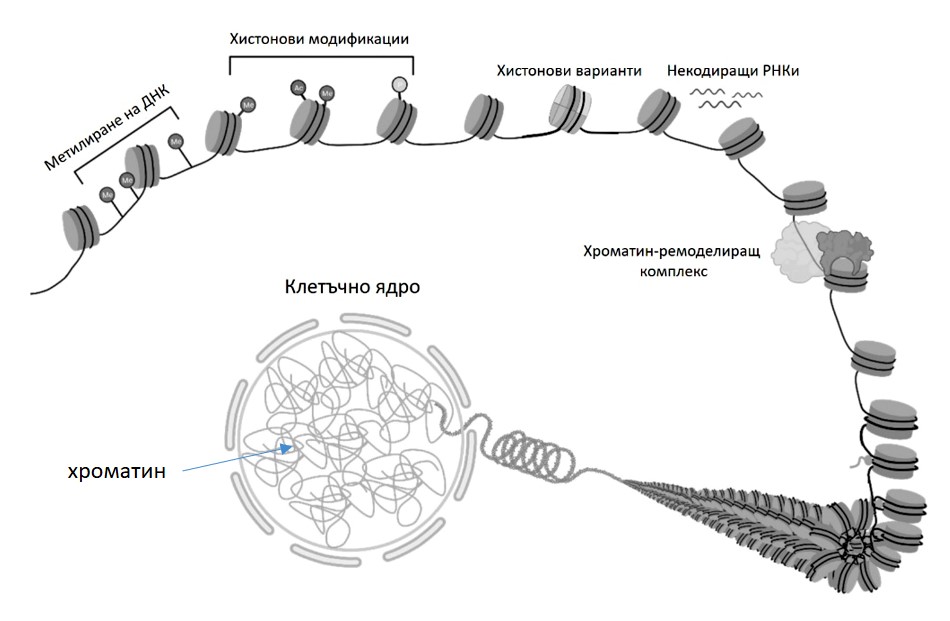
Засега са познати няколко механизма, чрез които се осъществява епигенетично унаследяване. Те са чрез: 1. Метилиране на ДНК; 2. Заместване на хистонови варианти; 3. Хистонови модификации; 4. Структура, динамика и ремоделиране на хроматина; 5. Участие на некодиращи РНК-и.
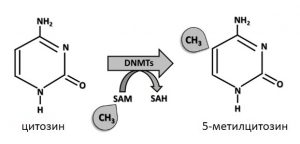
Метилиране на цитозин във веригата на ДНК. Метилирането се извършва от ензими ДНК-метилтрансферази (DNMTs), а метилната група се взима от S-аденозилметионин (SAM).
Метилиране на ДНК
Измежду епигенетичните механизми метилирането на ДНК е най-добре изучено. Този процес представлява добавяне на метилна група (-CH3) към цитозина в ДНК веригата .
Важно физиологично значение има когато метилирането се осъществява на местата във веригата на ДНК, където в последователността на нуклеотиди цитозинът е последван от гуанин, т.е. метилиране на цитозина в последователността нуклеотиди цитозин-гуанин (възприето е да се изписва CpG).
В допълнение, особено важно се оказва метилирането на ДНК в промоторите на гените. Метилирането на CpG в промотора на гена води до неговото умълчаване (генна репресия). Обратният процес де-метилиране в промотора води до активиране на съответния ген. Интересното за нас е, че ДНК-метилирането е регулируем процес. Метилирането може да се активира от храни, облъчване с УВ-светлина, въздействие на някои химикали. Това показва, че гените могат да бъдат активирани или умълчавани чрез въздействия на външни фактори. Така храните, температурата, физическата активност, психическият стрес и т.н. могат да активират или репресират гени в нашето тяло с всички произтичащи от това последствия.
Модификации на хистоните
Епигенетичните механизми, основаващи се на варианти на хистоните и хистонови модификации, включват така наречените хистонови протеини. За да може молекулата на ДНК, която за всяка човешка клетка е дълга около 2 метра, да се вмести в клетъчното ядро, което е с диаметър от 10 микрометра, ДНК трябва да бъде силно спирализирана и нагъната. Това се осъществява чрез контактите на ДНК със специфичните хистонови протеини и така се образува сложния нуклеопротеинов комплекс – хроматин .
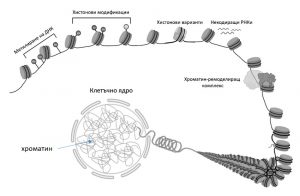
Компактизация на ДНК в хроматин чрез участието на хистонови протеини.
Динамична организация на хроматина
Всички организми, притежаващи ядро, с помощта на протеини – хистони пакетират своята ДНК в сложно организиран комплекс, наречен хроматин. При организмите без ядро (бактерии) ДНК също е пакетирана в сложен комплекс, но при тях хистоните са заместени от хистоноподобни протеини. Явно такава организация на генетичния апарат е изключително важна за осъществяване на функциите на ДНК. Това е и пример за това, че в еволюцията се запазва не само структурата на ДНК, но и начинът на пространствена организация на генома. Благодарение на организацията на генома в хроматин достъпът до ДНК на различни ензими е ограничен. За да бъде осигурен достъпът до ДНК на ензимите, извършващи транскрипция, репликация и поправка, хроматинът по и около гените трябва да бъде разплетен. Кондензирането и разплитането на хроматина са два противоположни и динамични процеса, протичащи непрекъснато в ядрото на живата клетка. По този начин хроматинът извършва важна регулаторна работа, определяйки кои области (и гени) от генома как и кога да се активират или умълчат. В основата на разплитането или кондензирането на хроматина лежат химически модификации на хистоните. Те се извършват от силно специализирани ензими, които добавят или отнемат от хистоните химически групи като ацетилна, метилова, ADP-рибоза и много други. Тези химически модификации на хистоновите протеини водят до разхлабване или обратно, до заздравяване на връзката им с ДНК. Така хроматинът може да бъде разплетен и отново кондензиран.
Некодиращи РНКи
Най-слабо изученият засега механизъм на епигенетичен контрол е участието на некодиращи РНКи. Отдавна се знае, че само около 1% от ДНК на клетката кодира гени. Останалите 99% от генома не кодират гени. Тъй като не беше ясно защо тази ДНК е необходима, дълго време се смяташе, че това е ненужна ДНК, отпадък от еволюцията. Дори наричаха тази ДНК “боклук” (junk DNA). С развитието на епигенетиката започна да става ясно, че този „ДНК боклук“ всъщност е много важен за синтеза на РНКи, които имат изключително важна регулаторна функция. Това са РНКи, които се синтезират върху матрицата ДНК, но не кодират информация за протеини. В детайли, тяхната роля е да се свързват с вече синтезирани от гените информационни РНКи или с определени, специфични участъци от геномната ДНК и по този начин предимно да намаляват или направо да инхибират синтезата от някои гени. Това е още един изключително сложен епигенетичен механизъм, изпълняващ контрол върху работата на генома.
Много важно е да се осъзнае, че епигенетичните механизми не работят самостоятелно и независимо. Те изпълняват организирано и последователно своята работа. Например след метилирането на някой участък от ДНК върху съответния участък се разполагат варианти на хистони, които са пряко зависими от метилирана ДНК. Следва химическа модификация на хистоните, подходяща за метилирана ДНК и така се изгражда съответно ниво на компактност на хроматина в този участък. Това е предпоставка за лесно или трудно разплитане на хроматина и определя нивото на активност на гените там. Епигенетичните механизми служат за фина настройка на работата на гените, което води до нормално функциониращи клетки. Затова те могат да се възприемат като епигенетичен контрол на генома.
Епигенетика и околна среда
Епигенетичните механизми въздействат живите организми и определят съдбата им, включително на нас, хората. Нещо повече, тези механизми не действат изолирано, само в даден момент. Те действат непрекъснато и до голяма степен определят бъдещия живот на организма, а дори и до голяма степен живота на поколението. Трябва да подчертаем, че епигенетични са механизмите в основата на така наречената „клетъчна памет“.
Най-силното доказателство, свързващо въздействието на условията на околната среда върху развитието и здравето, идва от проучвания върху деца на жени, които са били бременни по време на два периода на глад през Втората световна война: обсадата на Ленинград (1941–1944 г.) и Холандската гладна зима (1944–1945 г.). По време на глада в Холандия жените, които са били подложени на нисък калориен прием и свързаните с това фактори на околната среда в късните етапи на бременността, са раждали по-малки бебета. Тези деца в по-късни етапи от техния живот са показали повишен риск от инсулинова резистентност в сравнение с техни връстници, чиито майки не са били подложени на глад. Излагането на глад на различни етапи от бременността е свързано с широк спектър от рискове като повишено затлъстяване, по-високи нива на коронарна болест на сърцето и по-ниско тегло при раждане. Интересното е, че когато са изследвани 60 години по-късно, хората, изложени на глад пренатално, показват намалено метилиране на ДНК в сравнение с техните неизложени на глад еднополови братя и сестри.
Ние сме това, което ядем
Поговорката „ти си това, което ядеш“ е вярна дори на молекулно ниво: храната, която консумираме, това, което са консумирали нашите родители и дори баби и дядовци, се отразява на нашето лично развитие и на рисковете от заболяване в живота на зряла възраст. Хранителните вещества могат да обърнат или променят метилирането на ДНК и хистоновите модификации, като по този начин модифицират експресията на критични гени, свързани с физиологични и патологични процеси, включително ембрионално развитие, стареене и канцерогенеза. Хранителните вещества (това са веществата, които сега е модерно да се наричат „нутриенти“) могат да повлияят върху епигенома чрез инхибиране или активиране на ензимите, които метилират ДНК или извършват хистонови модификации. Например, плъхове майки, хранени с диета с ниско съдържание на метилова група по време на бременност, дават потомство с намалена експресия на ДНК-метилтрансфераза 1 (DNMT-1), което води до намалено генерално метилиране на ДНК. В допълнение се наблюдава и повишено ацетилиране на хистони, разположени в промоторите на специфични гени, включително глюкокортикоидния рецептор. Храненето по време на ембрионалното развитие и в ранна възраст може да повлияе епигенетичното програмиране в мозъка не само по време на ранното развитие, но и в живота на зряла възраст, като по този начин модулира здравето през целия живот. Затова изучаването на връзката между храненето и епигенетиката се разглежда като важен инструмент за предотвратяване на педиатрични заболявания на развитието, както и за забавяне на процесите, свързани със стареенето.
Епигенетика и медицина
За нас, разбира се, най-интересна е епигенетиката, която има отношение към медицината, т.е. действието на епигенетичните механизми, когато са отговорни за проявата на патологични състояния, за стареенето и за развитието на заболяванията.
Епигенетика и канцерогенеза
Може би най-важната част в изучаването на епигенетичните механизми е разбирането на това как те въздействат или се променят за злокачественото трансформиране на клетката, за превръщането ѝ в ракова клетка. И още по-важно е дали и как доброто познаване на механизмите би могло да помогне те да бъдат използвани за насочване работата на клетката в обратна посока, към възвръщане на нормалното състояние. Според съвременното разбиране, използвайки епигенетични механизми, патологично променени клетки могат да бъдат върнати обратно и да изпълняват своите нормални функции, точно както здравите клетки.
Още с откриването на метилирането на ДНК (1925 г.) се появяват предположения, че то може да има участие в канцерогенезата. През последвалите години са се натрупали огромно количество изследвания на това кога и как метилирането на ДНК може да доведе до злокачествено израждане на клетките и до иницииране на рак. Сега се възприема, че съществуват три главни пътища, по които това се случва. Те включват хипометилиране (т.е. ниско ниво на метилиране на ДНК) на генома на раковата клетка. Едновременно с това се наблюдава локално хиперметилиране на ДНК в промоторите на туморсупресорните гени. Третият път е чрез предизвикване на директни мутации във важни за деленето на клетката гени. Известно е, че метилирането на ДНК може да предизвика свързване на определени белтъчни фактори, което от своя страна прави съответния участък от ДНК по-податлив на мутации и съответно предразполага клетката към канцерогенеза. Като цяло, намаляването на ДНК-метилирането води до геномна нестабилност и това състояние е характерно за раковите клетки, в които се наблюдават множество мутации. Точно затова вече съществуват антиракови терапии, основани на познанията ни за метилирането на ДНК. Аналози на нуклеотидите успешно се използват за блокиране на ензимите, метилиращи ДНК (ДНК-метилтрансферази). Такива аналози блокират метилирането на промоторите на туморсупресорни гени в бързоделящи се клетки. Така туморсупресорните гени се активират и възпират деленето на раковите клетки. Такива терапии вече се използват в онкологичните клиники. Чрез тях има напредък в лечението на някои типове левкемии, особено при възрастни хора.
Съществуват подобни терапии, основани и на хистоновите модификации. Съществуват инхибитори на ензимите хистондеацетилази. Тяхното използване води до активиране на туморсупресорни гени, които са умълчани в раковите клетки. Ето защо химически съединения, които могат да инхибират хистондеацетилазите, са особено полезни в клиничната практика.
Интересното и важното в разработката на епигенетичните терапии е, че за тяхното действие са необходими сравнително ниски концентрации на съответните вещества, което не натоварва излишно организма на пациента. В посоката за разработване на антиракови терапии на епигенетична основа се работи усилено от много колективи по света и е сигурно, че скоро ще бъде постигнат голям напредък в тази област.
Епигенетика и психология
Науката епигенетика претърпя силно развитие в областта на психологията. Отдавна се знае, че случки в детството могат да окажат много дълбоко и продължаващо през целия живот влияние върху поведението на човека. Усилията да се разберат какви точно са тези промени на молекулно ниво намират своята реализация в изучаването на епигенетичните промени. Множество поведенчески прояви при хора и животни, както и различни нервни разстройства намират своето солидно обяснение в епигенетични механизми. Епигенетиката в психологията предоставя основа за разбирането на това как експресията на гените бива повлиявана от жизнения опит и околната среда, в която организмът прекарва живота си, за да се получат индивидуалните разлики в поведението, когнитивните способности, индивидуалността и душевното здраве.
Най-интересното епигенетично унаследяване е наблюдавано при изследване на предаваните от майката реакции на стрес при плъхове. При малки плъхчета майчиното отглеждане (облизване и сресване) през първата седмица от живота им е изключително важно, защото е свързано с дългосрочно програмиране на индивидуалните различия в реакцията на стрес, емоционалността, когнитивните възможности. Когато пораснат, потомците на майки с нормални нива на облизване и сресване показват повишена експресия на глюкокортикоидния рецептор в хипокампуса (мозъчна структура, свързана с чувствителността към стрес, както и с ученето и паметта). Обратно, плъхчетата имат по-нисък хормонален отговор на стрес в сравнение с възрастни животни, ако са отглеждани от майки, които рядко са ги облизвали и сресвали. Показано е, че всичко това е свързано с промени в нивата на генната експресия. Плъхове, които са получили ниски нива на майчино облизване и поддържане през първата седмица от живота, показват намалено ацетилиране на хистони и повишено ДНК-метилиране на неврон-специфичен промотор на гена на глюкокортикоидния рецептор. В резултат експресията на този ген се намалява, броят на глюкокортикоидните рецептори в мозъка намалява и животните показват по-висок хормонален отговор на стрес през целия си живот. Интересно е, че ефектите от грижите на майката върху реакциите на хормона на стреса и поведението на потомството могат да бъдат елиминирани в зряла възраст чрез фармакологично лечение (хистондеацетилазния инхибитор трихостатин А, TSA) или хранителни добавки с аминокиселини (L-метионин), лечения, които влияят на ацетилирането на хистони, ДНК метилиране и експресия на гена на глюкокортикоидния рецептор.
Открита е връзка между епигенетични промени и множество психически заболявания. Например индивидите, страдащи от синдромите на Прадер-Ули (Prаder-Willi syndrome, PWS) и Ангелман (Angelman syndrome, AS) се характеризират с наднормено тегло, нисък ръст, но освен това и с трудности в обучението, хиперактивност, емоционални изблици и агресивно поведение. Доказано е, че вариантите на синдромите се дължат на неправилен импринтинг, което представлява умълчване на генни локуси чрез метилиране на ДНК и силно компактизиране на хроматина със съответно модифицирани хистони и хистонови варианти. Подобни патологични промени в генната регулация, която се предава в поколения наред и могат да бъдат наблюдавани и при други синдроми, проявяващи се с психически отклонения като например, синдром на Рубищайн-Тейби (Rubistein-Taybi syndrome), синдромът на Рет (Rett syndrome) и много други. Ясно е, че е достатъчно да бъде неправилно засегната регулацията на активността на един ген или група от гени, без промяна в техния генетичен код, за да се появят тежки психологически отклонения. Добрата новина е, че за разлика от генетичните заболявания, за заболяванията, които се дължат на епигенетични причини, могат да бъдат изработени съответните терапии, стига механизмът на епигенетичната патология да е добре изучен. Именно затова в момента по света се полагат огромни усилия за разбиране и изучаване на епигенетичните закони, особено когато те са свързани с патологични състояния.
В заключение
Геномът и епигенетичните механизми са в сложно и силно зависимо взаимодействие. Те не могат да бъдат разбрани, ако се разглеждат като две различни системи. Те са „двете страни на една монета“. Ако си позволим да оприличим клетката на компютър, то тогава геномът е хардуера на компютъра, включващ самата кутия, платките, процесора, кабелите, мишката, монитора. От друга страна епигенетичните механизми са софтуера, това са различните програми, чрез които компютърът извършва някаква работа. Както не може да има компютър без хардуер, така и компютърът би бил безполезна кутия без съответната среда и софтуерни програми. По аналогия, геномът – хардуер и епигеномът – софтуер не могат да съществуват един без друг; те се обединяват и работят заедно, за да може клетката да функционира, да може да се адаптира към променящи се условия и изобщо – да е жива.