
Христо Б. Цветанов
Акад. Христо Цветанов защитава дисертация през 1970 г. в Института по органична химия – БАН. Работи в Института по полимери – БАН върху контролиран синтез на полимери и съполимери. Доктор на химическите науки е от 1987 г. Известен е с изследвания по водоразтворими амфифилни съполимери, получаване на интелигентни полимерни наночастички на тяхна основа, променящи структурата си при незначителни изменения на околната среда. Пионерни са изследванията му върху омрежване на водоразтворими полимери с помощта на УВ светлина. От 2005 г. е член-кореспондент на БАН, а от 2015 г. академик.
.
Водата е най-разпространеното съединение по повърхността на нашата планета – тя покрива 71% или близо 2/3 от земната обвивка. Човешкото тяло съдържа около 65% вода, а която и да е жива биологична клетка – поне 50%. На пръв поглед водата не предизвиква интерес – тя е вещество без вкус, без миризма, прозрачна, срещаме я навсякъде. Молекулата на водата е много стабилна за земните условия и напълно безвредна за живите организми. Това обаче не означава, че тя е инертна.

71% от повърхността на Земята е покрита с вода, показва тази снимка на NASA, направена от космическия кораб Apollo през 1972 година.
Водата участва в почти всички химични, биологични и геологични процеси на нашата планета. Нейната молекула, независимо от простата химическа структура, притежава уникални свойства както в чисто състояние, така и като разтворител. Без вода и по-точно – без нейните аномалии – няма живот. Всъщност животът е равнопоставено партньорство между биомолекулите и водата и зависи от нейната необикновена природа. Заслужава да споменем някои от най-характерните ѝ „аномални“ физични свойства:
- В сравнение с останалите хидриди от шеста главна подгрупа от таблицата на Менделеев (H2Te, H2Se, H2S), водата притежава много високи температури на замръзване (0°С) и на кипене (100°С). Благодарение на високия си специфичен топлинен капацитет (топлоемкост) тя служи като топлинен буфер (възможност да съхранява значително количество вътрешна енергия) и по този начин играе много важна роля за поддържане на екологичното равновесие на планетата. Акумулирането на слънчева топлинна енергия без значително повишаване на температурата във водните басейни през деня и бавното охлаждане през нощта допринасят за мекия климат на планетата.
- Водата притежава много голямо повърхностно напрежение в сравнение с повечето течности. Това обяснява защо върху водната повърхност могат да се придвижват дребни насекоми. Повърхностното напрежение е основен фактор при капилярните действия. В достатъчно тесни пространства (капиляри) комбинацията от повърхностно напрежение и силите на адхезия изкачва водата и така осигурява живителни сокове до върховете на най-високите дървета.
- Водата при замръзване не се свива, както е характерно за повечето съединения, а се разширява. Тя замръзва при 0⁰С, но при 4⁰С има най-голяма плътност. При замръзване преминава в кристално състояние като кристалната ѝ решетка е с по-голям обем. Затова ледът е по-лек от водата и „плува“ над повърхността. Тази особеност запазва условията за живот във водните басейни в студените зони. Когато ледът се образува и оформя на повърхността, служи като изолатор, с което се възпрепятства замръзването под него.
- Водата е универсален разтворител, който участва в многобройни химични и биохимични реакции.
- При контакт с неполярни молекули (напр. алифатни въглеводороди) се наблюдава хидрофобен ефект.
- Водата е способна да разтваря кислород, въглероден диоксид и други газове, без които е невъзможен животът във водните басейни.
- Без участие на вода е невъзможна фотосинтезата – процес, който е основен източник на кислород и хранителни вещества на нашата планета.
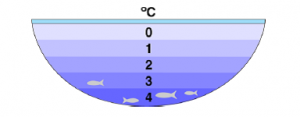
След замръзване на езеро рибите остават живи на дъното, където водата е в течно състояние
Водата е привличала интереса на учени и философи още от античността, като и днес тя все още крие своите загадки. Много изследователи се опитват да изградят ясна представа за физичните ѝ характеристики (топлинен капацитет, плътност, вискозитет, диелектрична константа и др.), като използват най-модерните физични и изчислителни методи. В съвременната теоретична химия компютърните симулации предоставят данни, сравними с опитните резултати.
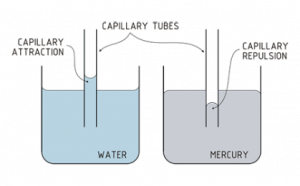
Капилярен ефект при водата и живака: при водата адхезионната сила (между течността и стената) е по-силна от междумолекулната кохезия и тя се изкачва в тясната тръбичка. При живака има слаба адхезия към стъклото
Учените са единни, че всички уникални свойства на водата се дължат на специфични междумолекулни взаимодействия с участието на водните молекули. Междумолекулните взаимодействия се определят като привличащи или отблъскващи сили между молекулите, от които зависят процесите на стапяне, кипене, сублимация, сгъване и разгъване при протеините, асоцииране и дисоцииране на молекулни агрегати и др. Може да се твърди, че способността на водните молекули да образуват мрежа от водородни връзки помежду си, които непрекъснато се разрушават и отново създават, води до коренно различното поведение в сравнение с повечето известни течности и обясняват „аномалните физични свойства“.
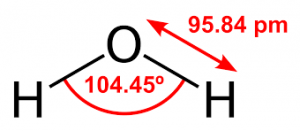
Структурна химическа формула на водата
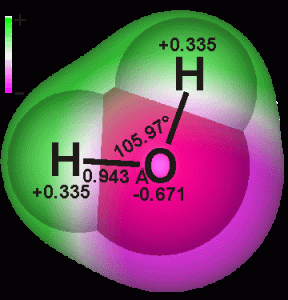
Молекулата на водата е малка с диаметър от около 2.75 Å и обем от 0.03 нм3. За сравнение, други широко разпространени молекули като тези на кислорода (O2), азота (N2) и въглеродния диоксид (CO2) са с по-големи размери.
Водата е чудесен пример за създаването на ясна представа за разликата между молекула и вещество. Водната молекула е градивната частица на веществото вода. Тя е мономер в супрамолекулната клъстерна организация на водата. В течно състояние всяка водна молекула е свързана чрез водородна връзка с поне още една водна молекула. Няма водна молекула, която да не участва в създаване на водородна връзка при контакт с друга водна молекула. Водородните атоми и свободните електронни двойки образуват тетраедърна форма с център кислороден атом и максимална координация от 4.
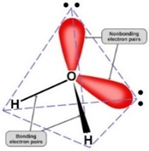
Тетраедърна форма на водната молекула
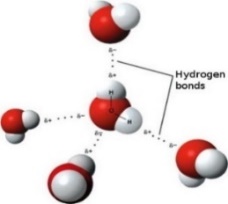
Клъстер от 5 молекули вода чрез водородни връзки
Схемата горе се приема като стандартна и общоприета представа за структурата на водата. За да разберем поведението и свойствата на водата и на нейните разтвори е необходимо детайлно познание за природата на водородните връзки на молекулно ниво. Водородната връзка е резултат от насочено специфично взаимодействие между ковалентно свързан водороден атом и електроотрицателен атом, например кислород, азот или флуор от съседна молекула (Фиг 8). За образуването на водородна връзка е необходимо участието на донор (D) и акцептор (A) на водород. Донорът е силно електроотрицателен атом (N, O, F и др.).
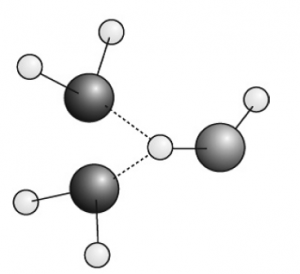
Чаталовидна водородна връзка при течна фаза
Характерът на водородната връзка е изключително сложен. Тя е преди всичко йонна (около 90 %), но и частично ковалентна (около 10%) със здравина най-често от порядъка на 2 15 ккал/мол. Най-характерните молекули, изграждащи водородни връзки едни с други са тези на амоняка, водата и флуороводорода.
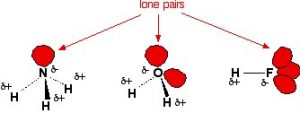
Структура на молекулите на амоняка, водата и флуороводорода
От трите молекули, водата е перфектен пример за създаване на мрежова структура от водородни връзки, защото нейната молекула притежава 2:2 съотношение между водородни атоми и несподелени електронни двойки. Способна е да участва в максимум 4 водородни връзки: две акцепторни връзки чрез свободните електронни двойки при кислородния атом и две донорни връзки чрез водородните атоми. Всеки водороден атом може да образува водородни връзки със свободните електронни двойки на кислородните атоми от съседни молекули. А кислородният атом може да взаимодейства с два водородни атома от други водни молекули. Резултатът е образуването на триразмерен клъстер.
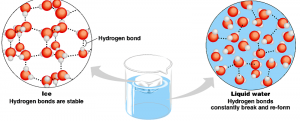
Водородни връзки при водата под формата на лед и течност
Тетраедричната координация на водните молекули е експериментално наблюдавана и доказана при всички познати модификации на леда. Ледът запазва перфектната тетраедърна симетрия около всяка водна молекула. При водата като течност, тетраедърната симетрия се нарушава.
Всяка молекула в течната фаза е свързана поне още с една чрез водородна връзка. Благодарение на водородните връзки течната вода представлява непрекъснато променяща се триразмерна мрежа, изградена по принципа, посочен във фиг 6. Мрежата от взаимносвързани водни молекули търпи промени, поради създаването на нови и разрушаването на вече създадени водородни връзки вследствие на температурни флуктуации (динамично взаимодействие).
За да се добие достоверна представа за водата с нейните уникални свойства трябва да се отговори на два въпроса: каква е структурата и каква е динамиката на мрежата от водородни връзки във водата.
Таблица 1. Видове междуатомни взаимодействия. Енергия на връзката и разстояния.
| Взаимодействие |
Разстояние H…A (Å) |
Енергия ккал/мол |
| Ван дер Ваалсово | ~ 3 – 4 | ~ 0.01 – 0.1 |
|
Слаби водородни Връзки |
2.2 – 3.2 | < 4 |
|
Средни водородни Връзки |
1.5 – 2.2 | 4 – 15 |
|
Силни водородни Връзки |
1.2 – 1.5 | 15 – 40 |
|
Ковалентни Връзки |
~ 1 | 80 – 100 |
Различаваме силни (15 – 40 ккал/мол), средни (4 – 15 ккал/мол) или слаби (1 – 4 ккал/мол) водородни връзки (табл. 1).
Способността на водородните връзки да се прегрупират, да се разрушават и отново да се създават, според промените на средата, води до образуване на водни клъстери, които са най-малките наноразмерни групи от асоциирани водни молекули, свързани помежду си с водородни връзки и притежаващи характерна мрежова структура. Водните клъстери са най-простият модел, демонстриращ по най-ярък начин връзката между молекулната и надмолекулната химия. Те представляват агрегати от водни молекули с размери (H2O)n определени както експериментално, така и с помощта на изчислителни методи. Животът им е изключително кратък от порядъка на пикосекунди (1 пс = 10-12 сек.). Можем да си представим водата като статистическа смес от малки водни клъстери (димер, тример и т.н.), които непрекъснато се превръщат в по-големи или по-малки клъстери чрез динамично равновесие. С други думи, ако водата е хомогенна в макроскопски размери, то тя е нехомогенна в наноразмерна скала и пикосекундно време.
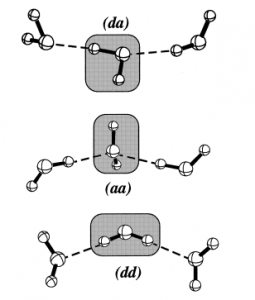
Възможни локални водородни връзки в мрежов воден клъстер
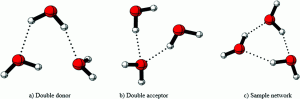
а) двоен донор б)двоен акцептор в) примерна мрежа
При изследването на строежа на клъстерите се приема, че водородните връзки между водните молекули не са равностойни, а представляват различни комбинации между протонен донор (d) и протонен акцептор (a), както е показано на схемите.
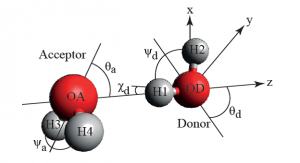

Димерът на водата (H2O)2 преобладава във водните пари и е най-простият модел за изследване на характера на водородните връзки между водните молекули. Той е първообраз на начина на образуване на водни клъстери и е изключително важна структурна част при изучаването на по-големите клъстери.
По-големите клъстери са с триразмерна структура като водният хексамер е най-малкият клъстер с триразмерна структура
Най-характерната черта на водородните връзки между водни молекули е тяхното неадитивно действие: две съседни водородни връзки могат да си влияят една на друга, което води до усилването или отслабването им. Кооперативността може да се охарактеризира като увеличаване на усреднената енергия на стабилизация на водородната връзка при даден клъстер, сравнена с енергията на водородната връзка при водния димер. Най-често след образуване на водородна връзка, следващата водородна връзка е по-силна.
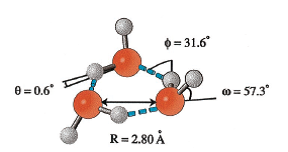
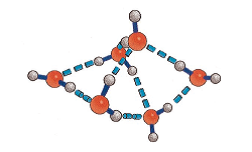
Схема на воден тример и воден хексамер
Преди повече от 200 години сър Хъмфри Дейви през 1810 (Humphry Davy, 1778 – 1829) и Майкъл Фарадей през 1823 (Michael Faraday, 1791 – 1867) са забелязали, че при контакт на газове с вода се образуват подобни на лед структури, наречени „газови хидрати“. Те се образуват при определени налягане и температура. Така например разтвор на метан във вода кристализира при 8°С при налягане от 50 бара.
Съвременната наука определя газовите хидрати като кристални съединения на включване (дефинирано от IUPAC като „клатрати-хидрати“), съставени от малки молекули „гости“, включени в клетки, подобни на структурите на леда и на големите водни клъстери, наречени „домакин“. „Гостите“ стабилизират мрежовата структура на „домакина“ чрез нековалентни Ван дер Ваалсови сили (връзки между атоми и молекули, зависими от разстоянието). Структурата на клатратите е свързана с предпочитаната ориентация на водните молекули около неполярни съединения (например въглеводороди) по начин, по който се запазват водородните връзки като деформирана тетраедърна структура (Фиг 17).
Характерно за клатратите е, че те не притежават строго стехиометрично съотношение газ/вода (Съотношение на веществата при химична реакция, при което няма излишък) и че много лесно се разрушават при нагряване или при понижаване на налягането. Отсъствието на химични връзки между „госта“ и „домакина“ е доказателство, че структурите не са химични съединения, а са едни от първите примери за образуване на надмолекулни /супрамолекулни/ образувания. Клатратите-хидрати са способни да съхраняват много ефективно газ /метан, пропан, водород, СО2 и др. като от 1 м3 газов хидрат могат да се отделят 160 м3 метан! Това им качество ги прави интересни за отнемане на СО2 от атмосферата и за съхранение и транспорт на въглеводородни газове, които са ценен енергиен източник. Почти сигурно е, че клатратите-хидрати ще изместят технологията за втечняване на природен газ и водород под налягане. Тъй като те са широко разпространени в природата, може да се приеме условно, че представляват необичаен вид минерал. (Фиг 17)
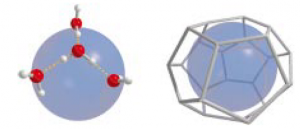
Всяка водна молекула около хидрофоб взаимодейства със съседни водни молекули под формата на силно деформиран тетраедър. Взаимодействието обяснява както образуването на клатрати, така и хидрофобния ефект
Големият интерес към клатратите-хидрати се дължи на огромното количество метан, складиран в тези структури в земните недра, представляващ изключително ценен природен горивен запас за човечеството. Газовите клатрати-хидрати на планетата са най-големият източник на въглеводороди на земята. При това те са достъпни, евтини, практически неизчерпаеми и атрактивни за индустриално приложение.
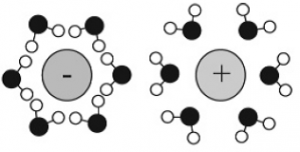
Ориентиране на водните молекули при солватиране на аниони и катиони
Друго изключително важно свойство на клатратите-хидрати е тяхната способност да съхраняват водород. Съхранението на големи количества водород при невисоки налягания е един от основните фактори за успешно развитие на „водородната икономика“.
Освен за съхранение и транспорт на природен газ и водород, клатратите-хидрати ще намерят в близко бъдеще важни приложения за улавяне и складиране на въглероден диоксид, разделяне на газове и обезсоляване на морска вода.
Водата е чудесен разтворител най-вече за вещества, съставени от йони, поради своята полярност и способност да образува водородни връзки. Всеки йон взаимодейства с водата като образува сферични пластове (солватационни сфери) от водни молекули, чиято структура се определя от размера и електрическия товар (заряд) на йона. Според товара на йона водните молекули около първата солватационна сфера се ориентират или откъм страната на кислородния атом, или откъм тази на водородните атоми (Фиг 18).
Силите на взаимодействие между йон и вода се определят от свойствата на йона (товар, размер, поляризуемост). В разредени водни разтвори различаваме две основни групи от йони: йони, структуриращи водните молекули или „космотропи“ (structure–making) и йони, разрушаващи структурата на водата или „хаотропи“ (structure–breaking).
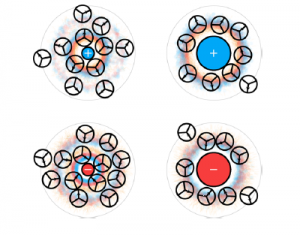
Около малки йони водните молекули са пространствено подредени поради силно електростатично взаимодействие. Около големи йони подредбата на водните молекули наподобява тази при взаимодействие с хидрофоби
Първата солватационна сфера от водни молекули около космотроп е по-здраво свързана с йона отколкото с друга водна молекула. При хаотроп водните молекули от първата сфера са по-слабо свързани с йона отколкото със съседните водни молекули. Разликите в структурирането на солватните сфери на космотропи и хаотропи са представени на Фиг 19.
Някои соли са способни да повишат разтворимостта на неполярни (хидрофобни) съединения във вода. Други предизвикват изсолване или утаяване. Ефектът сол – хидрофоб във водна среда е открит от Франц Хофмайстер (Franz Hofmeister 1850 – 1922) и се прилага при изсолване на протеини.
Ефектът от природата на йоните, изразен като критична концентрация за утаяване на белтъци, ги подрежда в ред на Хофмайстер. При един и същ катион ефективността към утаяване на белтък расте в реда:
SO4-2 > CH3COO– > OH– > Cl– > Br– > BF4– > F– > ClO4– >SCN–
За катиони (при един и същ анион) редът е следният:
Li+ < Na+ < K+ < Cs+ < NH4+ < N+(CH3)4 < Mg2+ < Ca2+
Въпреки, че в природата водата е естествената среда за извършване на биохимични реакции, в традиционния органичен синтез основните разтворители са органични съединения. При много органични реакции се препоръчва използването на органични разтворители без следи от вода! И сега химиците се съобразяват с добре известното правило „подобно се разтваря в подобно“ като в стремежа към получаване на добър добив от дадена химическа реакция, водата е станала нежелан участник.
Водата, обаче е била незаслужено пренебрегвана от химиците органици, защото тя е най-добрата алтернатива на органичните разтворители: нетоксична, безопасна, широкодостъпна и евтина. При използване на вода като реакционна среда се постига прилагане на по-прости и по-евтини операции, по-меки реакционни условия, при много реакции се постигат по-добри добиви и по-висока селективност.
След първите успешни синтези във водна среда, публикувани от Бреслоу и др. (Breslow) за реакции от типа Дилс-Алдер (Diels-Alder reaction, DA), интересът на изследователите към използването на водата в химични реакции нараства неимоверно. Постигнати са сериозни успехи в подобряване на добива при различни органични трансформации: циклоприсъединяване (диенов синтез); алдолна кондензация; органометални реакции; органичен катализ, фотореакции; реакции с участието на много компоненти и др. Фиг 20
Резултатите, представени на табл. 3, най-добре илюстрират огромното предимство при използването на водата като разтворител и среда за извършване на реакция от типа Дилс-Алдер
| Разтворител |
Скоростна константа К х 105 (M-1sec-1) |
| изооктан | 5.94 |
| метанол | 75.5 |
| вода | 4400 |
|
Вода/ β-цикло- декстрин |
10900 |
| Вода/ LiCl | 10800 |
Реакцията е проведена при 20 оС.
При реакции във вода се използват емулсии, повърхностноактивни вещества, катализатори, устойчиви на вода, наноразмерни частици и полимерни мицели. Много важен подход е стремежът към създаване и използване на реакционна среда, която да наподобява структурата на живите клетки и ензимите, включваща зони, способни да капсулират хидрофобни субстрати. Реакциите, извършващи се на междуфазова граница, показват много добри резултати. На междуфазовата граница водата се намира в ограничено и затворено малко нанопространство (confined water), което води до съществени изменения в нейни важни физикохимични характеристики (полярност, хидрофобни взаимодействия, водородни връзки). Малкият размер на затвореното пространство (не повече от 5 нм) води до разрушаване на траедърната структура и до промени в свойствата, които промотират редица химични и биохимични процеси.
Водата е течността, която улеснява транспорта в клетките. Тя не е пасивен участник в биологичните процеси. Много учени я определят като „биомолекула“ и имат своите основания. Водата е необходима, за да функционират ензимите. Добре известно е, че с увеличаване на хидратирането се увеличава тяхната активност.
Без вода белтъците (протеини) и нуклеиновите киселини всъщност не са реални биомолекули, тъй като губят специфичното си действие като не са в състояние да изпълняват своята биологична функция, както и да запазят своята уникална надмолекулна структура. Поради извънредно важната роля в биологичните процеси много учени определят водата като двадесет и първата аминокиселина или като една от „биомолекулите“.
Таблица 4. Количества свързана вода в ДНК и протеини
| Биомолекула |
Свързана вода, g/g |
| ДНК | 0.610 |
| Колаген | 0.465 |
| Серум албумин | 0.315 |
| Яйчен албумин | 0.323 |
| Миоглобин | 0.324 |
Много важно за изясняване на взаимодействието „биомакромолекула – вода“ е понятието „свързана вода“. „Свързаната вода“ се намира в контакт с биомолекулите, взаимодейства с техни функционални групи и се различава по свойства от водата като течност. На табл. 4 са представени данни за свързана вода в ДНК и в някои по-важни протеини.
Най-голямо е количеството свързана вода в ДНК, която притежава фибриларна /отворена/ структура и е полиелектролит. Най-малко е количеството „свързана вода“ при глобулните протеини, които притежават много по-малка специфична повърхност.
Взаимодействието с водни молекули при протеините (хидратиране) се осъществява преди всичко чрез техните полярни групи посредством образуване на водородни връзки. Хидратирането е движещата сила за конформационното „сгъване“ и „разгъване“ при протеините. Благодарение на взаимодействието с водата протеините придобиват подходяща конформация (сгъване), водеща до селектиране на отделни хидрофобни участъци под формата на хидрофобни ядра. Водата има определяща роля не само за оформянето на хидрофобното ядро при протеините, но и за запазване и стабилизиране на структурата му благодарение на създадената мрежа от водородни връзки между самите водни молекули.
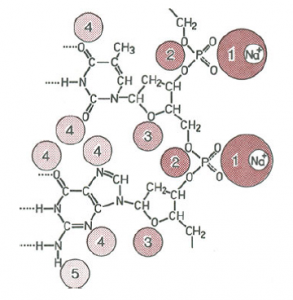
Предпочитани места за хидратиране в ДНК. Склонността към хидратиране е отбелязана от 1 (най-силно свързване) до 5. Солватацията около фосфатната група се осъществява с около 5 молекули вода
За разлика от многобройните изследвания върху ролята на „свързаната вода“ за функционалността и структурната стабилност на протеините, изследванията върху взаимодействието „вода – нуклеинови киселини“ са силно подценени, независимо от факта, че без вода, която да ограничава електростатичните отблъсквания между отделните фосфатни групи, включени в основната полимерна верига, не може да бъде стабилизирана хеликсната спирала на нуклеиновите киселини. Добре известно е, че конформационната структура на двойната спирала на ДНК зависи изцяло от „свързаната вода“ и начина на хидратация.
Както се вижда от таблица 4, нуклеиновите киселини са много по-хидрофилни от протеините. Фосфатните групи и техните противойони (Mg2+, K+) се солватират от водните молекули. Установено е, че около 25 водни молекули се свързват с една единица от ДНК под формата на две хидратиращи сфери. Представа за склонността към взаимодействие с вода на отделните части от ДНК е показана на Фиг 21.
От казаното по-горе могат да се направят следните изводи. Водата е възможно най-аномалната течност според физичните свойства, взаимодействието ѝ с йони, хидрофилни и хидрофобни молекули, междуфазови повърхности и др. Независимо от простата химична формула и изключителната важност за живота на нашата планета, досегашните знания за водата като чисто вещество, като разтворител и реакционна среда са недостатъчни и често противоречащи си.
Надмолекулната организация на водата е много сложно и не напълно изяснено явление, свързано с недостатъчно добре изяснена динамика на процесите. Характерно е, че индивидуалните процеси (например създаването и разрушаването на водородните връзки водещо до организиране на клъстери и клатрати) са свръхбързи от порядъка на пикосекунди. Структурата и функционирането на биомолекулите зависят в значителна степен от тяхната хидратна обвивка както и характерните водни резервоари, включващи много малко нано-пространство. Хидратната обвивка при биомолекулите също така играе ролята на топлинен резервоар и преносител на енергия.
Успешно моделиране на свойствата на водата ще допринесе за много „по-зелена“ и благоприятна за околната среда химическа индустрия. Малко хора знаят, че клатратите-хидрати са практически неизчерпаем източник на енергия (метан). За да се въведат нови технологии като: безопасно съхраняване на водород и метан, ефективно използване на вода като реакционна среда в химическата индустрия, добив на метан от клатрати-хидрати, революционни подходи в използването на ензимния катализ и др., е необходимо по-задълбочено изучаване на свойствата на водата с помощта на усъвършенствано компютърно моделиране и модерни физични методи, съчетани с погледа и възприятието на химика.
Публикуван сп. „Природа“ бр. 1/2023 г. стр. 4-16



