Румяна Койнова, Борис Тенчов
Проф. дбн Румяна Койнова и академик Борис Тенчов са работили съвместно в Института по биофизика на БАН. Акад. Тенчов е работил също в Медицински университет – София и е бил ръководител на катедра Медицинска физика и биофизика. Значителна част от техните научни изследвания са посветени на свойствата на липидните наночастици и на приложенията им като преносители на нуклеинови киселини.
Липидните наночастици (ЛНЧ) се появиха в медицината като обещаващо ново средство за пренос в организма на разнообразни терапевтични агенти, както малки лекарствени молекули, така също нуклеинови киселини и протеини. Със способността си да капсулират и пренасят лекарства до определени места в организма и да освобождават съдържанието си в желаното време, ЛНЧ представляват ценна платформа за лечение на широк кръг заболявания.
ЛНЧ имат приложения и в ред други области, като образна диагностика, козметика, хранене, селско стопанство, както и в някои иновативни направления – например, разработката на нанореактори. Днес в светлината на прожекторите е приложението им като критично важен компонент на новите РНК ваксини срещу COVID-19, където ЛНЧ играят ключова роля за защита и ефективно транспортиране на информационната РНК до клетките.
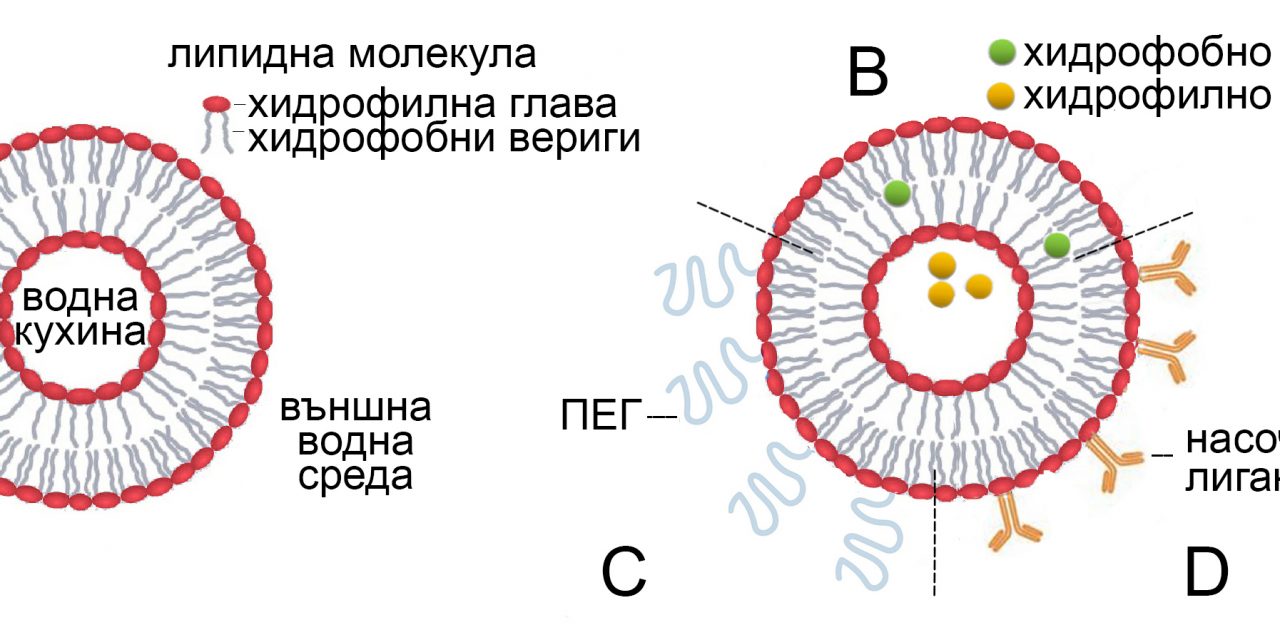
Липозоми – първо поколение липидни наночастици. Терминът „липозома“ е въведен през 60-те години на миналия век, малко след като бе установено, че липидни бислойни везикули (мехурчета) могат да се образуват спонтанно във водна среда (Фиг. 1). Тъй като липозомите се състоят от липидни молекули и, особено тези за терапевтично приложение, имат размери в нанодиапазона (под 1 микрометър), те с основание се считат за първо поколение липидни наночастици. Потенциалът на липозомите като система за пренос на лекарства е оценен почти веднага след откриването им. Всъщност липозомите са първата платформа в областта на наномедицината, която успешно е преминала всички етапи – от концепция до клинични приложения – и е довела до ред нови лечебни препарати. Първото липозомно лекарство е Doxil, одобрено през 1995 г., което включва антитуморния агент доксорубицин и се използва за лечение на рак на яйчниците. Друго липозомно лекарство (Epaxal) включва протеинов антиген в липозоми и се прилага като ваксина срещу хепатит. Липозомите са обект на многобройни клинични изследвания като система за пренос на противоракови, противовъзпалителни, антибиотични, противогъбични и анестетични лекарства, както и за генна терапия. В резултат, ред липозомни препарати са одобрени за употреба като лекарства и ваксини
Основни липозомни съставки са най-разпространените природни фосфолипиди като фосфатидилхолин, фосфатидилетаноламин, фосфатидилсерин и фосфатидилглицерол, както и пластификатора холестерол Липозомите се състоят от един или няколко липидни бислоя и обикновено имат размери в диапазона от 20 до 1000 нм. Хидрофилните лекарства могат да бъдат капсулирани в техния вътрешeн воден обем, докато хидрофобните лекарства могат да бъдат включени в областта на въглеводородните вериги на липидния бислой. Това прави липозомите универсална платформа за доставка както на водоразтворими, така и на водонеразтворими лекарства. Структурата на липозомите зависи от начина на тяхното приготвяне. Има няколко основни вида липозоми – малки еднослойни везикули (SUV) с диаметър 20 – 100 нм, големи еднослойни везикули (LUV) с диаметър 100 – 1000 нм, гигантски еднослойни везикули (GUV) с диаметри над 1000 нм и многослойни везикули (MLV) , с диаметри около 500 нм, в които концентричните бислоеве образуват многослойна структура, подобна на лукова глава. Като системи за доставка на лекарства се използват SUV, LUV и MLV.
термостат, който реагира на промените в температурата и включва/изключва отоплението.
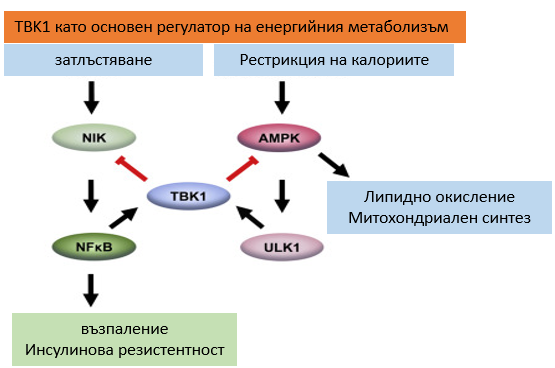
С помощта на миши модели се доказва, че хроничният стрес, предизвикан от наднорменото тегло, предизвиква възпаление чрез активацията на пътя на NFKB (важен път в клетките, регулиращ имунния отговор, растежа и клетъчната смърт). Този път активира поредица от гени, включително TBK1. Той, от своя страна, потиска AMPK – основен регулатор на разхода на енергия, като намалява способността на клетките да изгарят енергия и води до натрупване на мазнини. Така напълняването индуцира възпаление, което отново засилва пълнеенето. Обратно, когато TBK1 не е активен, AMPК засилва метаболизма на мастните клетки, в резултат на което те изгарят калории.
От друга страна, NKFB активира гена TBK1, а той, по типа на обратната връзка, може да инхибира NKFB. Активацията на TBK1 редуцира възпалението, макар да не го елиминира напълно. Но без TBK1, възпалението отново расте. Делецията (премахването) на TBK1 при затлъстели мишки води до загуба на тегло и повишаване на възпалението, но при мишки с нормално тегло не предизвиква никакви промени.
TBK1 на кръстопътя на възпалението и енергийната хомеостаза в адипозната (мастната) тъкан
Потискането на TBK1 има потенциал да възстановява енергийния баланс при състояние на затлъстяване, като повишава способността на клетките да изгарят мазнините. Днес се предполага, че това не е основният път за загуба на енергия, но все пак е насока за това как може да се въздейства върху метаболизма.
Един от възможните инхибитори на TBK1 се нарича амлексанокс (Amlexanox), противовъзпалително и противоалергично лекарство, използвано за лечение на астма, което е създадено през 1980 година в Япония.
Един от механизмите на неговото действие е да потиска възпалението, като намалява освобождаването на хистамин и левкотриени. Освен че потиска TBK1, има същия ефект и върху IKK-3 (Inflammatory Kinase) и така съдейства за намаляване на теглото и повишаване на чувствителността на клетките към инсулин. В статия, публикувана в сп. Cell Metabolism, се говори за значителна редукция на кръвната захар в клинично проучване на пациенти със захарен диабет, които са използвали амлексанокс за 12 седмици. Когато лекарството е давано на мишки със затлъстяване, те губели тегло, чувствителността им към инсулин се покачвала, повлиявайки положително върху диабета и стеатозата (омазняването на черния дроб).
Резултатите се подобряват при комбиниране на амлексанокс с тетрадецилтиооцетна киселина (TTA). Това е мастна киселина, която регулира отлагането на мазнини в клетките и контролира метаболизма. При прием помага на човек да се засити по-бързо и намалява чувството на глад. Освен това, тази мастна киселина има антивъзпалителни и засилващи имунитета свойства и не преминава процес на бета-окисление в митохондриите. Основни нейни ефекти са, че стимулира пролиферацията на митохондриите (увеличаване на броя на основни енергийни органели в клетката) в черния дроб и намалява серумните триглицериди (мазнини) и общия холестерол. В последните изследвания дори се твърди, че ТТА подобрява функцията на миокарда при сърдечна недостатъчност.
Основните ефекти на инхибитора амлексанокс са: 1. Намаляване на телесните мазнини, 2. Подобряване на глюкозния контрол, 3. Подобряване на инсулиновата резистентност, 4. Нормализиране на нивата на HbA1C (гликирания хемоглобин).
За съжаление, някои хора не се повлияват на лечението с амплексанокс. При тях той не действа и причината за това е все още неясна. Ето защо изследователите смятат, че все пак двупосочното действие остава най-печелившо: ограничаване на енергийния прием чрез диетата и повишаване на енергийния разход чрез изгаряне на повече калории. Само диетите не действат достатъчно ефективно.
Около 1% от световната популация са много слаби хора, независимо от това, че не спортуват или ядат много. Международен екип идентифицира кандидат-ген, отговорен за ниското тегло на някои хора. След анализиране на проби от 47 000 човека от Естонската биобанка бил установен генът ALK, който потиска натрупването на мазнини при метаболитно слаби хора. При отстраняване(делеция) на ALK при лабораторни мишки, те, мишките остават слаби и това доказва, че този ген регулира разхода на енергия. Лекарства инхибитори на ALK се използват сравнително отдавна при лечение на някои видове рак. Дали прилагането на ALK инхибиторите е свързано с дълготрайно намаляване на теглото предстои да бъде установено в бъдеще.
Изследвания на ALK гена при Drosophila (плодова мушица) и мишки показват, че потискането на генната експресия води до резистентност към натрупване на тегло при висококалорийна диета. За разлика от FTO, ALK има висока експресия и в мозъка и директно „инструктира“ мастните клетки да активират мастния си метаболизъм. Естонската национална биобанка е много подходяща за такова изследване, защото включва хора от широк възрастов диапазон (между 18 и 44 години) с ясни фенотипни характеристики. По-нататъшните изследвания следва
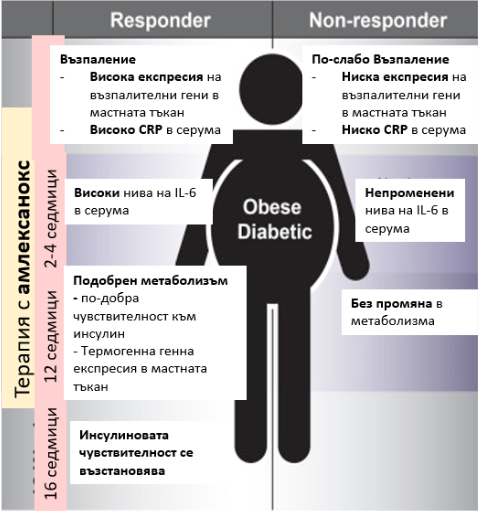
Повлияващи се (responders) и неповлияващи се (non-responders) пациенти на терапията с амлексанокс
да репликират (повторят) резултатите при друга голяма група пациенти и последващи метаанализи. Ако резултатите при хората се сравнят с мишки и плодови мушици, ще се установи еволюционното дърво на метаболизма, ролята на ALK и подлежащите биохимични и генетични зависимости.
ALK генът, обаче, не е единствената причина хората да бъдат постоянно слаби. Независимо, че ролята му вече е доказана, все пак съществуват и други фактори, които действат в комбинация с „добрите гени“:
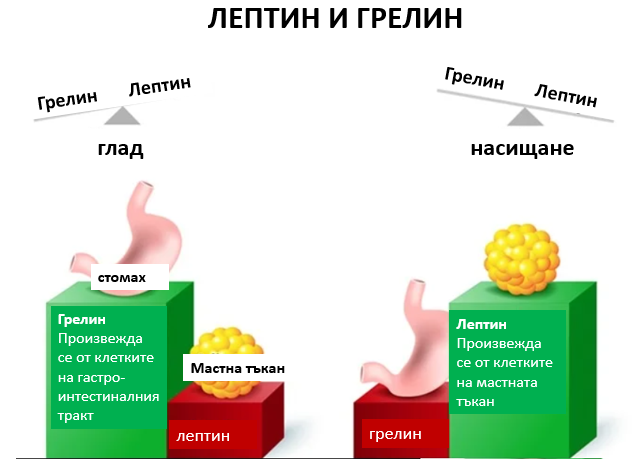
Действие на лептина и грелина
– Те имат навика да ядат само когато са наистина гладни. Понякога става въпрос за психическо пристрастяване към храната, а при тях то отсъства.
– Гладът се контролира от два хормона – грелин и лептин. Лептинът, който се продуцира от мастните клетки, потиска апетита, докато грелинът има обратно действие – той стимулира апетита. Хората с повишена чувствителност към лептин или повишена продукция на този хормон могат по-лесно да контролират теглото си.
Грелинът е хормон, произведен от ентероендокринните клетки на гастроинтестиналния тракт, особено в стомаха и често се нарича „хормон на глада“. Нивата му са най-високи при усещане за глад и се нормализират след хранене. Този хормон подготвя тялото за прием на храна – стимулира движението на червата и секрецията на стомашен сок.Релинът въздейства пряко върху мозъка, като активира клетките на хипофизната жлеза и хипоталамуса, включително невропептид У невроните, които отговарят за апетита.
От своя страна лептинът е хормон, основно синтезиран от мастните клетки и ентероцитите в тънкото черво. Той спомага за поддържане на баланса като потиска глада и намалява отлагането на мазнини в мастните клетки. Той действа върху клетъчни рецептори в хипоталамуса в мозъка, като ги насища. При затлъстяване се развива понижена чувствителност на клетките към лептин (подобно на инсулиновата резистентност при тип 2 диабет). Така пълните хора не получават чувство на ситост, независимо от повишеното отлагане на енергия и високите нива на лептин.
Отдавна е известно, че сънят също има отношение към теглото. Хормоните се регулират най-добре при поне 7 часа сън на денонощие. Липсата на сън води до постоянно високи нива на грелин, а тялото свръхпродуцира кортизол – хормон, който събужда глада. Накратко, повече сън води до по-ниско тегло. Добрите хранителни навици също имат значение. Ако ядем бавно и дъвчем повече, мозъкът има по-дълго време да сигнализира тялото, че е настъпило засищане.
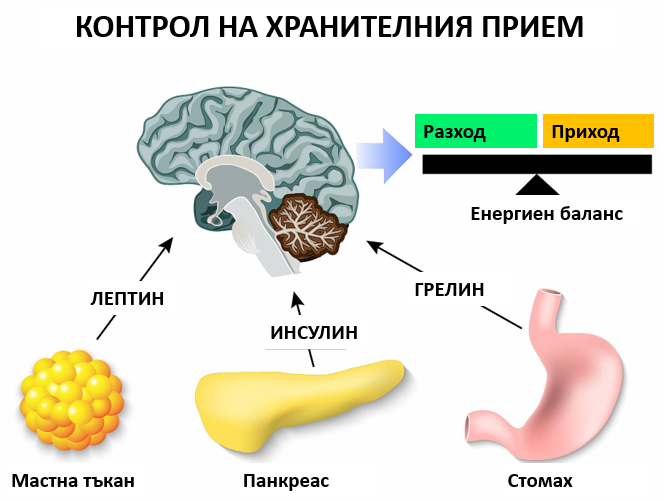
Хормонален контрол на хранителния прием
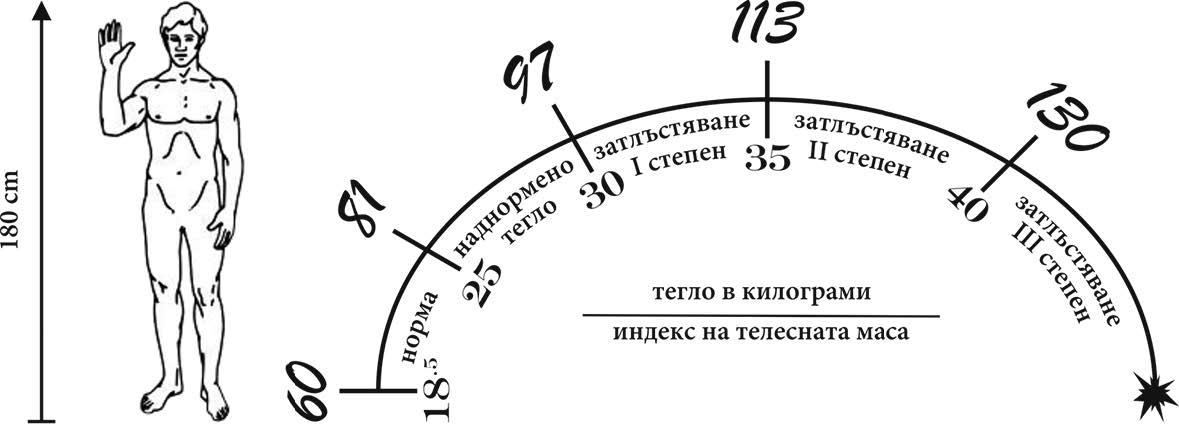
Нормално тегло (кг) и степени на затлъстяване при ръст 180 cm
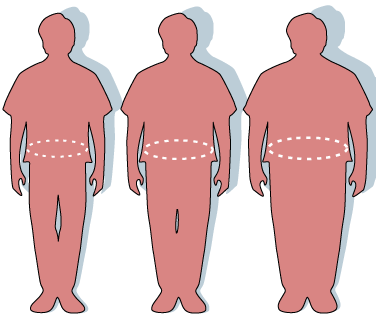
Силуети и обиколки на талията, които показват нормално телосложение (вляво), наднормено тегло (в средата) и затлъстяване (вдясно). Схема Уикипедия
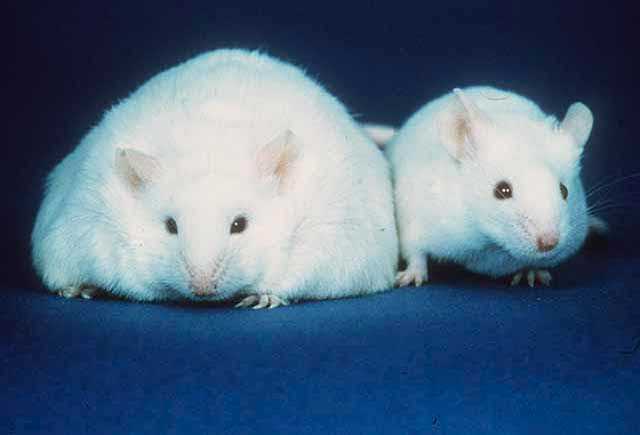
Сравнение между мишка, неспособна да произвежда лептин, което води до затлъстяване (вляво) и нормална мишка (вдясно)
И затлъстяването, и патологичната слабост днес се считат не само за козметичен дефект. Те са комплексни заболявания, мултифакторни, социалнозначими и до голяма степен предотвратими. И докато за слабостта няма все още ясни данни, то затлъстяването и наднорменото тегло засягат 30% от световната популация днес. Според някои прогнози до 2030 година, около 38% от световната популация в зряла възраст ще е с наднормено тегло, а 20% – със затлъстяване. Първенството по отношение на тази тенденция все още се държи от САЩ, но все повече от развиващите се страни почти достигат тези нива. Това показва необходимостта
и нуждата от нови, ефективни лекарствени средства за контрол и баланс на енергийния метаболизъм. Неслучайно натискът върху фармацевтичната индустрия все повече нараства, а наличните продукти все още са ненапълно ефективни и безопасни.
Публикуван сп. „Природа“ бр. 3/2021 г. стр. 22-30